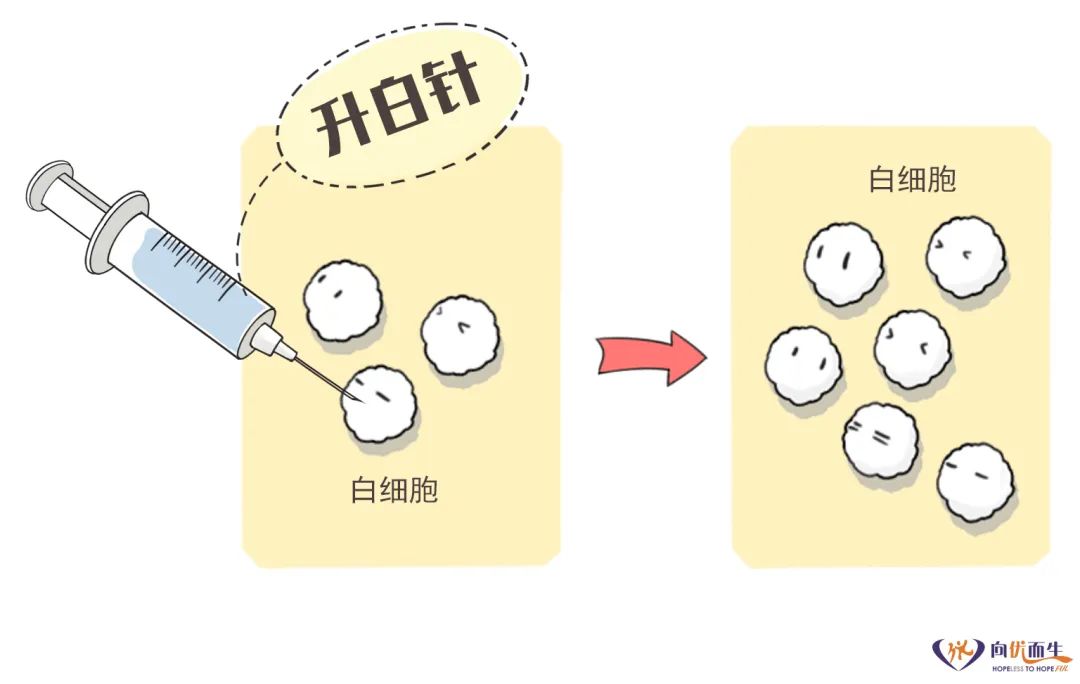
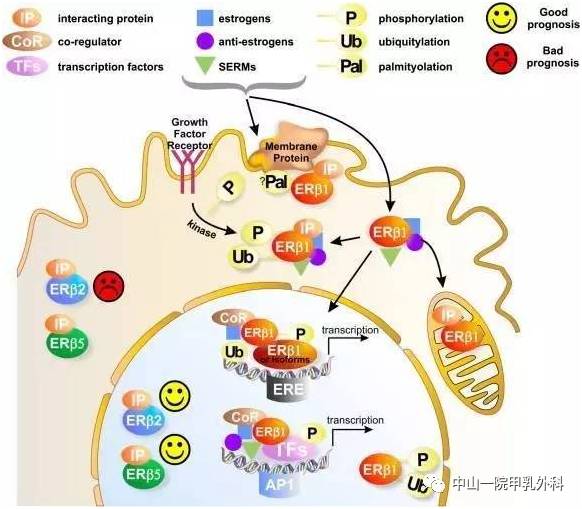
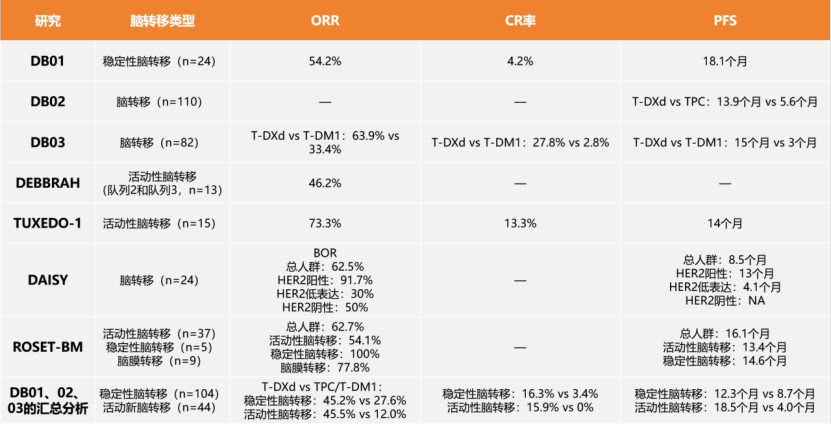
【摘要】 CDK4/6抑制剂为激素受体(HR)阳性人表皮生长因子受体2(HER-2)阴性乳腺癌患者的临床管理模式带来革新。全球上市的CDK4/6抑制剂包括Palbociclib/ target=_blank class=infotextkey>哌柏西利、Ribociclib和阿贝西利。对于HR阳性HER-2阴性局部晚期和转移性乳腺癌,CDK4/6抑制剂联合芳香化酶抑制剂或氟维司群一线或二线及以上治疗均可大幅度降低疾病进展或死亡风险,不良反应可控。鉴于CDK4/6抑制剂联合内分泌治疗在中国的临床应用刚开始起步,国家肿瘤质控中心乳腺癌专家委员会和中国抗癌协会肿瘤药物临床研究专业委员会组织相关领域专家,制定了CDK4/6抑制剂临床应用专家共识,系统性介绍CDK4/6抑制剂的药理学特征、用药监测以及不良事件管理等,以期加深临床肿瘤医师对CDK4/6抑制剂药物的认知,推进临床决策的精准性,达到延长患者生存时间和提高生活质量的最终目标。 【主题词】 乳腺肿瘤;CDK4/6抑制剂;雌激素受体;孕激素受体;人表皮生长因子受体2 DOI:10.3760/cma.j.cn112152-20210113-00045 乳腺癌是女性最常见的恶性肿瘤,治疗方法的不断革新很大程度改善了患者的总体生存和预后。约70%的乳腺癌患者为激素受体(hormone receptor, HR)阳性和人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)阴性。自首个CDK4/6抑制剂Palbociclib/ target=_blank class=infotextkey>哌柏西利于2015年获得美国食品药品监督管理局(Food and Drug Administration, FDA)批准,CDK4/6抑制剂分子靶向药物的应用改变了HR阳性HER-2阴性晚期乳腺癌的临床治疗模式,患者生存也获得突破性改善。2018年美国临床实践中接受CDK4/6抑制剂+内分泌一线治疗的患者比例已达到48.7%,但在中国CDK4/6抑制剂联合内分泌治疗临床应用相对滞后,为了加深临床医师对此类药物的认知,国家肿瘤质控中心乳腺癌专家委员会和中国抗癌协会肿瘤药物临床研究专业委员会组织相关领域专家,制定了CDK4/6抑制剂临床专家诊疗共识,介绍此类药物的作用机制、临床获益和不良反应特征,指导临床使用及疗效的监测并管理相关不良反应。 CDK4/6抑制剂高效精准地抑制乳腺癌细胞中CDK4和CDK6激酶的活性,阻断Rb蛋白磷酸化,从而阻滞细胞周期从G1期到S期的进程,从而抑制肿瘤细胞增殖。同时,CDK4/6抑制剂抑制上游雌激素受体信号通路的表达,与内分泌治疗之间存在协同增效的作用,达到延缓和逆转内分泌耐药。 CDK4/6抑制剂联合芳香化酶抑制剂(aromatase inhibitor, AI)的临床研究(PALOMA-2、MONALESSA-2、MONARCH-3和MONALESSA-7)均入组一线治疗的HR阳性HER-2阴性晚期乳腺癌患者(表1)。尽管每个研究的无进展生存时间(progression-free survival, PFS)略有差异,但与AI相比,CDK4/6抑制剂联合方案均降低疾病进展风险近50%,风险比(hazard ratio,HR)为0.54~0.58。目前,仅MONALEESA-7研究的总生存率有了初步结果,Ribociclib联合内分泌治疗绝经前和围绝经期患者随访42个月,总生存率分别为70.2%和46.0%,死亡风险下降约30%,其他研究的总生存率结果尚未达到,但基于Flatiron电子病历的美国真实世界研究,验证了哌柏西利在晚期一线治疗中总生存时间(overall survival, OS)的获益。 CDK4/6抑制剂与氟维司群联合治疗HR阳性和HER-2阴性局部晚期和转移性乳腺癌的一线或二线疗效相似。PALOMA-3、MONARCH-2和MONALEESA-3研究是关于CDK4/6抑制剂联合氟维司群用于既往内分泌治疗失败的重要的Ⅲ期研究(表2)。PALOMA-3、MONARCH-2和MONALEESA-3研究入组的患者大部分为接受二线及后线治疗的患者,MONARCH-2和MONALEESA-3研究中50%以上为接受一线治疗的患者,MONALEESA-3研究有19%为初治的患者。与CDK4/6抑制剂联合AI研究结果类似,尽管入组人群不同,但CDK4/6抑制剂联合氟维司群减少疾病进展的风险类似,疾病进展风险下降40%~50%,HR为0.50~0.59;死亡风险下降20%~30%,HR为0.72~0.79。PALOMA-3研究意向治疗人群的OS未达到统计学差异,可能与入组患者多为后线治疗有关,78%为二线和后线治疗患者,约30%的患者接受过解救化疗。 尽管CDK4/6抑制剂联合AI或氟维司群治疗HR阳性和HER-2阴性晚期乳腺癌的疗效相似,但基于各研究的亚组分析结果,某些入组人群可能稍有差异,具体表现在以下亚组:(1)原发内分泌耐药亚组中,阿贝西利或Ribociclib组联合氟维司群组与安慰剂联合氟维司群治疗组相比,可明显延长OS,哌柏西利联合氟维司群组OS结果未达到统计学差异;(2)非内脏转移亚组中,阿贝西利联合氟维司群降低疾病进展风险和死亡风险的获益有限,哌柏西利或Ribociclib联合氟维司群可以明显降低疾病进展风险和死亡风险;(3)单纯骨转移亚组中,哌柏西利联合来曲唑或者氟维司群均显示获益,而阿贝西利似乎获益有限,阿贝西利联合氟维司群在MONARCH-2研究中不能明显降低此亚组人群的死亡风险;(4)对于辅助内分泌治疗结束到随机入组的无治疗间期(treatment free interval, TFI)≥3年的亚组人群,阿贝西利联合AI对降低疾病进展的风险有限,而哌柏西利或Ribociclib联合AI使此类亚组人群获益明显。目前这些结果均为非预先设计的亚组分析,不能充分说明CDK4/6抑制剂在这些亚组人群中的疗效存在差异。CDK4/6抑制剂是否对这些亚组人群的疗效有差异,需要针对目标人群进行头对头的临床研究证实。因此,以上亚组人群结果仅供临床医师参考。对于其他亚组,包括65岁以上的老年亚组、内脏转移、高肿瘤负荷(转移灶累及器官数≥3个)和TFI<3年的患者,CDK4/6抑制剂疗效相似。 HR阳性和HER-2阴性局部晚期和(或)转移性乳腺癌且不合并内脏危象的患者,均是CDK4/6抑制剂联合内分泌治疗的适用人群。中国晚期乳腺癌规范诊疗指南和欧洲肿瘤内科学会指南定义,内脏危象是通过症状和体征、实验室检查和疾病快速进展评估的器官功能障碍。有症状、高肿瘤负荷的内脏转移并不全是内脏危象,内脏危象是同时伴随重要的器官损害,临床上可能迅速导致器官功能衰竭,进而危及生命,需要采取最快速有效的治疗。内脏危象包括:(1)肺淋巴管转移并且静息状态下需要吸氧;(2)静息时呼吸困难迅速加重,胸腔积液引流未能缓解;(3)弥漫肝转移且胆红素≥1.5倍正常上限(无胆道梗阻的情况下);(4)广泛的骨髓转移;⑸脑膜转移;⑹有症状的脑实质转移。骨髓广泛转移临床化疗耐受性差的患者,可以考虑CDK4/6抑制剂联合内分泌药物治疗。 基于CDK4/6抑制剂的临床研究数据,辅助内分泌治疗期间复发、或辅助内分泌治疗结束1年内复发的HR阳性和HER-2阴性晚期乳腺癌患者,均可考虑使用CDK4/6抑制剂联合氟维司群或CDK4/6抑制剂联合AI治疗。辅助内分泌治疗结束1年后复发或初诊即为转移性的HR阳性和HER-2阴性乳腺癌患者,可考虑CDK4/6抑制剂联合AI治疗。化疗和单药内分泌治疗仅作为备选的传统治疗方案(图1)。 根据FDA药品说明书,药品介绍见表3。 CDK4/6抑制剂主要被肝药酶CYP3A代谢,CYP3A抑制剂、诱导剂和敏感底物可能与CDK4/6抑制剂存在着相互作用。CYP3A抑制剂会降低CDK4/6抑制剂的代谢,使药物浓度增加,导致不良反应增加,CDK4/6抑制剂应避免和强效CYP3A抑制剂联用,如不能避免同时使用,应降低CDK4/6抑制剂的使用剂量。CYP3A诱导剂会加快CDK4/6抑制剂的代谢,可能会影响CDK4/6抑制剂的疗效,因此,CDK4/6抑制剂应避免和强效CYP3A诱导剂联用。因CDK4/6抑制剂会增加CYP3A敏感底物的暴露量,CDK4/6抑制剂与治疗指数较窄的底物联合使用,可能会导致敏感底物的毒性增加,所以联用时可能需要降低CYP3A敏感底物的剂量。联合用药的类型和CDK4/6抑制剂使用的注意事项详见表4。 CDK4/6抑制剂不良反应类型有所不同(详见不良反应管理内容)。基于药物的不良反应差异,特殊人群使用见表5。用于老年人群时,CDK4/6抑制剂在安全性方面均未观察到与年轻人群的差异。临床研究发现,Ribociclib可能引起QT间期延长,所以合并心血管基础疾病或者合并用药的患者应谨慎使用Ribociclib。阿贝西利常伴有腹泻和增加静脉栓塞的风险,因此,要谨慎用于胃肠疾病患者以及合并有血栓或高凝状态的乳腺癌患者。对于基础骨髓功能欠佳的患者,要谨慎选择哌柏西利和Ribociclib及其初始剂量。肝胆疾病的患者,在肝功能重度损伤的情况下CDK4/6抑制剂需要减量。CDK4/6抑制剂均具有胚胎毒性,孕妇禁用。 根据FDA药品说明书,CDK4/6抑制剂的临床监测指标、频率和相关管理建议见表6。CDK4/6抑制剂均需监测血常规,尤其是在前2个治疗周期;多重化疗后的患者或者老年患者建议每周监测血常规。阿贝西利和Ribociclib还需要监测肝功能,Ribociclib需要监测心电图和血清电解质。 晚期患者注重疗效的同时,同样需要关注其治疗相关不良反应和生活质量。CDK4/6抑制剂相关研究证实,其治疗疗效达到并超出了患者的预期,不良反应与患者预期相当或优于预期,可以耐受。 CDK4/6抑制剂研究数据显示,哌柏西利和Ribociclib治疗最常见的不良反应为中性粒细胞减少,阿贝西利最常见不良反应为腹泻,服用阿贝西利或Ribociclib都可能出现3~4级的肝转氨酶升高,阿贝西利有5%患者出现静脉栓塞,Ribociclib治疗的患者中3%~7%出现QT间期延长。CDK4/6抑制剂治疗相关的间质性肺病(interstitial lung disease, ILD)或肺炎发生率较低,但出现相应症状,仍需要关注并随访。临床实践中不良反应相应管理见表7。 1.中性粒细胞减少:中性粒细胞减少是CDK4/6抑制剂最常见的不良反应类型,其中哌柏西利和Ribociclib中性粒细胞减少的比例最高,3~4级中性粒细胞减少的比例为60%~66%。尽管临床研究数据显示,哌柏西利引起中细粒细胞减少的发生率较高,但中性粒细胞减少性发热的发生率仅为1.8%。CDK4/6抑制剂的中性粒细胞减少在亚裔患者中发生率更高。PALOMA-2研究显示,亚洲患者的中性粒细胞减少发生比例高于非亚洲患者,阿贝西利的Monarch-plus研究显示,中国患者中性粒细胞减少的发生率高于全球患者。CDK4/6抑制剂引起骨髓抑制的机制不同于化疗,CDK4/6抑制剂引起细胞周期阻滞,不引起细胞凋亡,停药后骨髓细胞恢复增殖,中性粒细胞减少是可逆的,不会影响生活质量。 专家组推荐意见:建议患者在中性粒细胞计数≥1 000/mm3开始CDK4/6抑制剂治疗,治疗期间每个周期的第1天和第14天监测血常规。如果出现≤2级中性粒细胞减少,无需调整剂量;如果出现3级中性粒细胞减少伴发热或者4级中性粒细胞减少,需要立刻停药,待恢复至≤2级,降低1个剂量治疗,可考虑使用粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)治疗;首次出现3级中性粒细胞减少,无需调整剂量,如果3级中性粒细胞减少再次出现,需要停药待恢复至≤2级中性粒细胞减少,降低1个剂量治疗。多重化疗后的患者或者老年患者建议每周监测血常规。 2.腹泻:阿贝西利最常见的不良反应为腹泻,3级腹泻发生率为9%,腹泻对患者的生活质量有不良影响。动物实验显示,阿贝西利治疗后出现增生性肠病,其形态学特征为微绒毛严重丧失和肠上皮细胞空泡变性;而哌柏西利和Ribociclib对肠上皮细胞形态没有影响,CDK9作为一种转录调节蛋白,可能介导了阿贝西利治疗引起的肠道毒性和腹泻。尽管目前没有证据表明肠道损伤或腹泻是否会影响患者肠道营养吸收,但需要关注长期出现此类不良反应是否会影响晚期肿瘤患者的营养吸收。严重的腹泻会引起电解质紊乱,增加QT间期延长的风险,因此腹泻的管理需要重视。腹泻分级(较基线)为1级:<4次/d;2级:4~6次/d;3级:>6次/d;4级危及生命。 专家组推荐意见:患者在首次出现稀便时开始抗腹泻治疗,进食软质易消化的食物,症状严重时及时就医。通过止泻药物和调整CDK4/6抑制剂剂量可有效控制腹泻。 3.QT间期延长:严重QT间期延长的患者有猝死风险。Ribociclib治疗会增加心脏毒性的风险,包括QTcF>480 ms或QTcF>500 ms、与基线相比QT延长>60 ms;而QT间期延长通常会导致Ribociclib治疗中断和降低剂量。晚期乳腺癌患者暴露于多种含心脏毒性的化疗药物,因此,更容易发生心律失常或心功能障碍。Ribociclib治疗时,为了监测心脏事件,需要在治疗的第1个周期的第1天和第15天以及后续治疗周期的第1天监测心电图和血清电解质,避免Ribociclib与已知具有延长QT间期潜在风险的药物联用,尤其是抗心律失常药物和其他已知可延长QT间期的药物。 4.静脉血栓栓塞(venous thromboembolism, VTE):VTE事件包括深静脉血栓、盆腔静脉血栓、脑静脉窦血栓、锁骨下和腋静脉血栓,下腔静脉血栓以及肺栓塞。VTE的发生直接影响患者的生活质量和长期预后,患者死亡和并发症的风险明显增高。一项Meta分析对比了CDK4/6抑制剂或内分泌单药治疗晚期乳腺癌,阿贝西利治疗发生VTE的风险最高,汇总风险比为6.77;哌柏西利和Ribociclib的风险相当,分别为2.33和2.19;在早期乳腺癌阿贝西利辅助治疗研究中也有2.3%的患者发生VTE,0.9%为肺栓塞。因此,CDK4/6抑制剂治疗期间需关注和预防VTE的出现,监测患者深静脉血栓形成和肺栓塞的症状和指征,如有异常及时请相关科室会诊并进行药物治疗。如果血栓没有危及生命,通常可以继续抗肿瘤治疗,同时根据相关科室意见进行抗血栓治疗。 5.肝毒性: Ribociclib的3~4级肝毒性反应发生率略>10%;阿贝西利的3~4级肝毒性发生率为3.8%~6.4%。因此建议,在Ribociclib或阿贝西利治疗的前2个周期的第1天和第15天以及后续治疗周期的第1天监测肝功能。哌柏西利导致的肝毒性出现较少,通常不需要监测肝功能。天门冬氨酸氨基转移酶和(或)谷氨酸氨基转移酶分级:1级:1~3×ULN(正常值上限);2级:>3~5×ULN;3级:5~20×ULN;4级>20×ULN。 6.ILD:CDK4/6抑制剂治疗相关的ILD发生率极低。哌柏西利、Ribociclib、阿贝西利相关的任何级别ILD或肺炎发生率分别为1.0%、1.1%和3.3%,3或4级IDL发生率分别为0.1%、0.3%和0.6%;哌柏西利无ILD致死病例,Ribociclib和阿贝西利引起的ILD死亡率分别为0.1%和0.4%。FDA特别警告,CDK4/6抑制剂治疗期间可能出现ILD的风险。药物诱导ILD分级:1级(轻度):无症状,仅影像学表现;2级(中度):有症状,但不干扰日常生活活动;3级(重度):有症状,且干扰日常生活活动或有吸氧指征;4级(危及生命或致残):危及生命或需要呼吸机支持;5级(致死性):死亡。 乳腺癌患者不仅承受疾病带来的压力,同时还要面对乳房缺失导致的心灵创伤。延长生存时间和提高生活质量是晚期乳腺癌治疗的两大重要目标,尤其是晚期乳腺癌患者,体能状况可能较早期患者差,因此在治疗的同时,更要关注治疗对其生活质量的影响。CDK4/6抑制剂联合内分泌治疗并未明显影响患者生活质量,由于治疗的有效性,可减轻患者疼痛,提高患者的生活质量。中国各大指南和共识一致推荐,CDK4/6抑制剂联合内分泌治疗药物用于HR阳性和HER-2阴性晚期乳腺癌的一线治疗,这积极推动了CDK4/6抑制剂的临床可获得性,使广大患者获益。一、CDK4/6抑制剂作用机制和疗效

二、临床应用指导
(一)适用人群

(二)药物介绍

(三)药物相互作用

(四)特殊人群的使用

(五)用药期间常规临床监测指标和时间

(六)不良反应管理

三、结语